
Valutazione della sintesi proteica nello stato di malnutrizione
La definizione più recente di malnutrizione è quella dell’Organizzazione Mondiale della Sanità (OMS) nel 1987: “uno stato di squilibrio, a livello cellulare, fra il rifornimento di nutrienti e di energia – troppo scarso o eccessivo – e il fabbisogno del corpo per assicurare il mantenimento, le funzioni, la crescita e la riproduzione”.
Il termine comprende perciò sia i danni da deficienza alimentare, tipici dei paesi in via di sviluppo, sia quelli da alimentazione eccedente, più frequenti negli ambienti industrializzati.
L’equilibrio tra l’assunzione dei nutrienti calorico-proteici e la spesa energetica garantisce non solo la stabilità tra massa grassa e massa magra di un individuo, ma è di fondamentale per il mantenimento dello stato di salute.
Tutte le cellule e i tessuti contengono proteine. In un uomo adulto del peso di circa 70 kg, il 16% del peso è dovuto a proteine (cioè circa 11 kg). Un’elevata percentuale è contenuta nei muscoli (43%), seguiti dalla cute (15%) e dal sangue (16%). Metà del contenuto proteico è rappresentata da solo quattro tipi di proteine: collagene, emoglobina, miosina e actina.
Da solo il collagene rappresenta il 25% del totale.
Le proteine esistono nell’organismo in uno stato dinamico, perché sono costantemente coinvolte in processi di sintesi e di degradazione. Ogni proteina possiede una sua funzione specifica, che può essere sia strutturale, di protezione, intesa come immunità, enzimatica, di trasporto o di comunicazione cellulare.
La carenza proteica può manifestarsi nell’organismo in due modi:
- Come deplezione proteica somatica, nella quale la perdita è a carico soprattutto dei muscoli;
- Come deplezione viscerale, nella quale la perdita è sostenuta dal fegato, dal pancreas e dall’intestino; in situazioni avanzate sono interessati anche cuore e cervello. Quest’ultima è una manifestazione meno comune.
La perdita dell’equilibrio nutrizionale può portare all’instaurarsi in tempi più o meno brevi di una sindrome di malnutrizione proteico energetica (Protein Energy Malnutrition, PEM).
Nelle persone a rischio, in particolare nella popolazione ospedalizzata, un idoneo ed efficace programma nutrizionale dovrebbe prevedere come base di partenza una valutazione dello stato nutrizionale e delle esigenze clinico-metaboliche. Senza l’uso di screening nutrizionali molti pazienti malnutriti sfuggono all’attenzione.
Secondo studi condotti anche in Italia, la prevalenza della PEM negli istituti che ospitano anziani va dal 23 all’85%, quella della popolazione ospedaliera dal 29 al 40% dei soggetti affetti da malattie croniche.
Caratteristica di tutte le forme di PEM è la carenza di substrati energetici e proteici necessari per l’attività dei meccanismi di difesa immunitari. Stati infiammatori e processi di riparazione tessutale hanno bisogno di quantità elevate di energia.
In generale, lesioni e traumi sono caratterizzati da una risposta infiammatoria. In fase acuta sotto l’influenza delle citochine, il bilancio tra sintesi e degradazione proteiche subisce uno spostamento. Substrati di provenienza endogena sono messi a disposizione a supporto dell’attività del sistema immune.
Nei muscoli la sintesi proteica si riduce, mentre la degradazione può essere incrementata, con il risultato di una perdita netta di proteine. Gli aminoacidi di origine muscolare vengono indirizzati alla sintesi proteica nel fegato e nel sistema immunitario. Nel fegato il tipo di proteine sintetizzate viene modificato, con riduzione della formazione delle proteine fisiologiche di secrezione (albumina, transferrina, proteina legante il retinolo) e aumento di quelle della fase acuta (proteina C reattiva, alfa-1-glicoproteina acida, alfa-2-macroglobulina, ecc.).
Sia l’aumento del fabbisogno metabolico di base, che i fabbisogni per entità di malattia sono stimabili con l’uso di appositi fattori: a questi corrispondono apporti energetici raccomandati che vedremo più avanti.
Tra le conseguenze cliniche della PEM sono state osservate: ritardo nella guarigione delle ferite chirurgiche, deficit della risposta immunitaria con aumento della suscettibilità alle infezioni, aumento di frequenza delle complicanze, aumento di mortalità post-operatoria.
Non ci sono ancora criteri universalmente accettati per definire la gravità della malnutrizione. Una diminuzione maggiore del 10% del peso corporeo abituale, soprattutto se la velocità con cui diminuisce supera il 3-6% al mese, è sicuramente un buon indice di malnutrizione. Alcune semplici valutazioni possono essere utili in fase di screening: misure antropometriche, BMI, plicometria, capacità muscolare, la velocità del cammino e le capacità motorie di base.
Con l’uso di questi parametri, il riconoscimento della malnutrizione avviene comunque in una condizione avanzata.
Un’altra causa di PEM sono i disturbi del comportamento alimentare, che comprendono un insieme di patologie caratterizzate da alterazioni di tipo psicologico e di tipo organico, classificate come anoressia nervosa e bulimia nervosa con le loro varianti. Il fenomeno è presente prevalentemente nel mondo occidentale industrializzato.
Viene logico pensare a un’ampia area d’intervento, quello sul soggetto sano, come fondamento di prevenzione, per regolare all’origine lo stato di salute complessivo.
Sostenere la corretta sintesi proteica permette all’organismo di svolgere autonomamente le regolazioni di base offrendo così un nuovo punto di vista nella promozione della salute.
La misura della concentrazione di metaboliti attraverso i test di laboratorio viene utilizzata per valutare lo stato di nutrizione di un organismo o la sua risposta al trattamento nutrizionale: si possono ottenere informazioni sul bilancio proteico-energetico, bilancio idrico, stato vitaminico e minerale, funzione di organi.
Per la valutazione delle proteine circolanti (“viscerali”) si utilizza la determinazione quantitativa nel siero di albumina, transferrina, prealbumina o transtiretina, proteina legante il retinolo. Poiché queste proteine hanno velocità di sintesi ed emivita differenti (l’emivita dell’albumina è di circa 21 giorni, quella della proteina legante il retinolo di circa 12 ore), alcuni di questi parametri riflettono modifiche dello stato nutrizionale più rapidamente di altre. Per esempio, una caduta nella concentrazione di albumina o transferrina circolanti accompagna spesso stress fisiologici importanti, come infezioni e traumi, e non indica necessariamente malnutrizione o scarso introito di proteine. D’altra parte, perché la loro concentrazione ritorni a livelli normali dopo la risoluzione dei fattori di stress, un supporto nutrizionale adeguato in proteine e calorie è indispensabile. Se così non avviene, le necessità proteiche e caloriche dell’organismo devono essere rivalutate per adeguare l’apporto nutrizionale.
Diventa quindi prezioso un corretto inquadramento funzionale del soggetto che scandisce in modo preciso tempi e modi di intervento.
Bisogna quindi ripensare allo stato di post-guarigione del paziente, fornendo il corretto substrato perché avvengano le funzioni di recupero e rinnovamento. Trattandosi di meccanismi intra-cellulari, alle normali funzioni di regolazione con i Sali di Shuessler, favoriremo la sintesi proteica fornendo un’adeguata miscela aminoacidica.
Sulla base di questo, l’accudimento e l’espressione di bisogni ulteriori da parte del paziente, possono essere accompagnati da nutraceutici di riferimento negli specifici casi.
Il ruolo del farmacista, del biologo, del medico stesso, trovano in questo punto di vista, maggiore sicurezza prescrittiva ed è logico pensare a un maggior successo terapeutico evinto nella risposta del paziente.
L’inquadramento funzionale del soggetto, uniti a una breve scheda anamnestica di facile compilazione, in cui evidentemente conoscere l’utilizzo di farmaci, esempio PPI, la qualità dei pasti, intesi nella loro modalità di consumo e nei tempi della masticazione, aprono a una prima valutazione.
Seguiranno domande abituali quali la qualità del sonno e del materiale fecale.
La valutazione dell’assorbimento intestinale infatti, diventa un aspetto altrettanto importante.
Ragionando quindi in un’ottica di intervento funzionale, diventa uno strumento prezioso la miscela aminoacidica, più sicura e corretta di quella proteica per i motivi che vedremo in seguito.
E’ facile intuire come l’equilibrio proteico sia alla base dell’intera salute.
Le Proteine
Prima di parlare di amminoacidi dobbiamo inevitabilmente parlare della fonte alimentare da cui derivano, ossia le proteine che rappresentano una delle tre fonti energetiche alimentari, insieme ai carboidrati ed i lipidi.
Le catene proteiche sono costituenti fondamentali dell’essere vivente che l’organismo, non essendo in grado di sintetizzare, assume con l’alimentazione, in modo preformato e ad intervalli regolari.
Muscoli, unghie, pelle presentano un elevato tenore proteico. Le proteine sono formate da amminoacidi legati tra loro; ogni proteina può anche contenere una sequenza di 30.000 amminoacidi.
La Società Italiana di Nutrizione Umana (SINU) stabilisce nel 2014 che i livelli di assunzione di riferimento per la popolazione italiana di proteine sono i seguenti:
Il fabbisogno proteico medio per la popolazione adulta italiana è 0,7 g/kg/die;
La dose raccomandata nella popolazione adulta italiana 0,9 g/kg/die;
L’obiettivo nutrizionale per la prevenzione popolazione anziana italiana (>60 anni) è 1,1 g/kg/die.
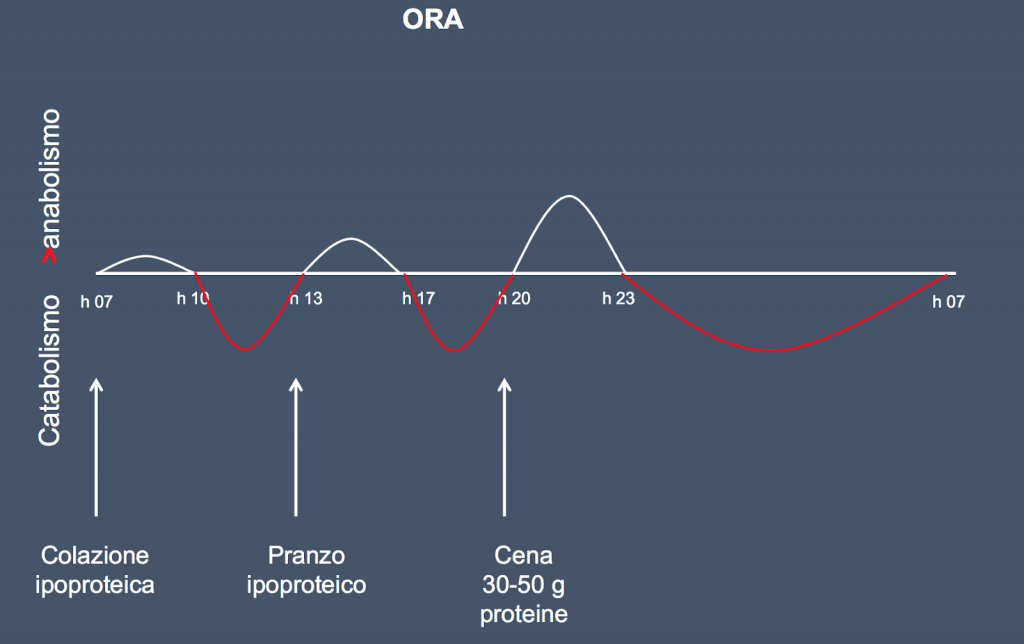
Le proteine devono essere digerite per rendere disponibili gli aminoacidi. La digestione delle proteine dipende da una corretta funzione gastrica e pancreatica, attraverso la produzione di HCl ed enzimi. Il pancreas, per produrre gli enzimi digestivi consuma grandi quantità di energia e circa il 60% degli aminoacidi introdotti con la dieta. Una diversa composizione aminoacidica determinerà anche una differente digeribilità proteica: il potere anabolizzante è molto diverso tra loro.
Bisogna ripensare a un corretto modello alimentare che vada a ripartire nei tre pasti principali il giusto apporto proteico, sostenendo, nei soggetti per cui si rende necessaria, la funzionalità dell’apparato digerente e intestinale.
Il professionista della salute è quindi chiamato a dover scegliere tra una miscela proteica e una aminoacidica in considerazione del soggetto che si trova di fronte. In principio possiamo affermare che la scelta della seconda supererebbe problemi di digeribilità e richiede minor impiego di ATP dell’organismo.
I singoli aminoacidi infatti sono rapidamente assimilati dall’apparato digerente senza consumo di energia (ATP). Il trasporto all’interno delle cellule avviene in funzione del gradiente sangue/citoplasma cellulare. Più è rapido l’incremento della concentrazione nel sangue più è rapida l’entrata nella cellula.
Il sostegno della sintesi proteica nel tempo richiede la presenza di tutti gli aminoacidi essenziali in concentrazioni specifiche, sufficienti a generare un delta di concentrazione plasmatico (almeno 4 g di aminoacidi).
Gli Aminoacidi
La scoperta degli amminoacidi essenziali, cioè di quelle sostanze necessarie per il normale svolgimento delle varie funzioni dell’organismo, iniziò nei primi anni dell’Ottocento, con la identificazione del primo amminoacido, la leucina, cui seguirono la fenilalanina, la lisina, la valina, il triptofano, l’isoleucina, la metionina ed infine nel 1935, ad opera di Mc. Coy, Rose e Meyer, la treonina.
Già all’inizio del Novecento fu chiara l’importanza degli amminoacidi e quindi delle proteine nella alimentazione. Infatti, nel 1946 Rose sosteneva: “La necessità quotidiana degli amminoacidi essenziali”; nello stesso anno Block e Mitchell affermavano che: “Il valore biologico di una proteina dipende dai suoi amminoacidi costituenti”, mettendo in evidenza l’importanza degli amminoacidi essenziali.
Altra data fondamentale è il 1946, quando la comunità scientifica riconosceva l’importanza primaria del ruolo degli amminoacidi nella nutrizione.
Gli aminoacidi (o amminoacidi) sono l’unità strutturale primaria delle proteine.
Possiamo quindi immaginare gli aminoacidi come mattoncini che, uniti da un collante chiamato legame peptidico, formano una lunga sequenza che dà origine ad una proteina.
Le proteine sono i muri portanti della struttura corporea e nel contempo svolgono una vasta gamma di funzioni all’interno degli organismi viventi.
Le proteine non possono venire assorbite senza essere scisse, all’interno dello stomaco e del duodeno questi legami vengono rotti ed i singoli aminoacidi giungono sino all’intestino tenue, dove vengono assorbiti come tali ed utilizzati dall’organismo.
Esistono aminoacidi essenziali e non essenziali.
Sono definiti essenziali quegli aminoacidi che l’organismo umano non riesce a sintetizzare in quantità sufficiente a far fronte ai propri bisogni. Per l’adulto sono nove e più precisamente: fenilalanina, isoleucina, lisina, leucina, metionina, treonina, triptofano e valina e istidina.
Sono considerati aminoacidi semiessenziali la cisteina e la tirosina, in quanto l’organismo li può sintetizzare a partire da metionina e fenilalanina.
Affinché la sintesi proteica possa concludersi positivamente, la presenza relativa di aminoacidi essenziali dev’essere ottimale. Infatti, se anche solo uno di questi risultasse carente, assumerebbe il ruolo di aminoacido limitante rendendo impossibile la sintesi proteica.
E’ assolutamente indispensabile l’utilizzo di una formula bilanciata di aminoacidi essenziali per poter sostenere le funzioni vitali.
L’uso di aminoacidi semiessenziali e di alcuni non essenziali velocizza le funzionalità di sintesi, di detossificazione e di produzione energetica.
Tra gli essenziali troviamo i tre amminoacidi ramificati, Leucina, Valina ed Isoleucina.
La Leucina è importante per la crescita e per la resistenza muscolare, in quanto stimola sintesi proteica e sostiene il metabolismo nei periodi di digiuno poichè ha attività chetogenica.
La Valina svolge importanti funzioni nella ricostruzione dei tessuti, soprattutto muscolari, motivo per il quale è particolarmente adatta nell’impiego sportivo laddove questo comporta uno sforzo fisico consistente e degenerativo per i muscoli ed il suo rapido assorbimento a livello intestinale la rende quasi immediatamente disponibile.
L’Isoleucina infine è strettamente legata al fabbisogno di glucosio, infatti in carenza dello stesso, per esempio al termine di un esercizio fisico, questa viene utilizzata come fonte energetica sostitutiva. E’ in grado di stimolare le cellule che producono insulina e quindi risulta amminoacido utile nel soggetto diabetico.
La Fenilalanina invece è coinvolta in tutti i processi metabolici messi in atto dal nostro corpo e da essa dipende la produzione di dopamina, neurotrasmettitore fondamentale per la regolazione della frequenza cardiaca e per quella del sonno e dell’umore.
La Lisina partecipa invece alla sintesi dell’ormone della crescita e alla fissazione del calcio nelle ossa, mentre la Metionina aumenta le capacità depurative del corpo umano, svolgendo una buona azione lipolitica a livello del fegato.
L’Istidina favorisce la sintesi delle proteine muscolari, ossia actina e miosina, e delle proteine deputate al trasporto e alla formazione delle riserve di ossigeno, cioè emoglobina e mioglobina.
Va a comporre la carnosina, potente antiossidante ad azione antinvecchiamento.
La Treonina, cosi come la Lisina, è un costituente degli anticorpi e riveste quindi un ruolo cruciale nell’equilibrio del nostro sistema immunitario, entra anche in gioco nelle funzioni depurative di fegato e reni ed è un precursore di collagene ed elastina, importanti componenti della nostra matrice extracellulare.
Altro amminoacido di primaria importanza è il Triptofano, chiave nelle sintesi proteica e nella sintesi di neurotrasmettitori come la serotonina, che come sappiamo può essere convertita in melatonina e che gioca quindi un ruolo fondamentale nella gestione del ritmo sonno-veglia.
Infine la Tirosina è un amminoacido imprescindibile nella costituzione di neurotrasmettitori come la dopamina, l’adrenalina e la noradrenalina, fondamentali per il sostegno delle capacità adattative dell’organismo, in virtù di situazioni stressogene. É inoltre coinvolta nella sintesi degli ormoni tiroidei e della melanina.
E’ un amminoacido molto consumato dal nostro organismo in situazioni di stress e aumentato catabolismo , per cui in caso di carenza diventa limitante per la sintesi proteica.
La Cistina garantisce la corretta sintesi di taurina e quindi di sali biliari, fondamentali nei processi di detossificazione epatica, di glutatione e di cheratina, proteina fondamentale per la corretta strutturazione degli annessi cutanei.
In ultimo la Serina, fondamentale per il tropismo del sistema nervoso in quanto presente nelle proteine che costituiscono il cervello e le guaine mieliniche dei nervi. E’ precursore del triptofano, favorisce l’assorbimento di creatina, supportando la massa muscolare ed è coinvolta nella biosintesi delle purine, costituenti degli acidi nucleici.
Tra i protagonisti della ricerca nutrizionale degli ultimi anni troviamo l’aminoacido ramificato Leucina, in parte a causa dei suoi effetti anabolici sui muscoli e in parte grazie agli effetti anti-obesità che derivano dal suo impatto benefico sulla tolleranza al glucosio, sul metabolismo lipidico e sulla sensibilità all’insulina.
Negli anni passati è già stato dimostrato in vivo e in vitro come la leucina influenzi il metabolismo lipidico ed energetico accelerando l’ossidazione degli acidi grassi, nonché la sintesi e/o la secrezione di citochine, favorendo una riduzione dell’adiposità.
Oggi ne viene valutata la supplementazione come promettente strategia terapeutica per trattare l’obesità e le sue conseguenze come l’insulino-resistenza, il diabete e le malattie cardiovascolari.
Uno studio del 2011 condotto su oltre 4.400 uomini e donne di mezza età ha trovato una correlazione tra un maggiore apporto dietetico di aminoacidi a catena ramificata (Bcaa) quali valina, leucina e isoleucina, e ridotte probabilità di sovrappeso o obesità, risultati confermati da un successivo studio brasiliano del 2015, in cui è stato osservato un ruolo significativo della leucina.
La leucina somministrata a livello centrale inibisce l’assunzione di cibo e il peso corporeo negli animali obesi attraverso l’attivazione della via mTOR nel nucleo arcuato ipotalamico e regola il rilascio di ormoni, come la leptina e la grelina, che possono potenzialmente influenzare l’assunzione di cibo nel tratto gastrointestinale e depositi di grasso.
Un altro meccanismo ipotizzato può essere l’aumento indotto dalla leucina nel dispendio energetico a riposo. In un lavoro del 2018 la supplementazione di leucina in vivo e in vitro ha migliorato significativamente la respirazione mitocondriale dei macrofagi e la produzione di Atp.
La supplementazione di leucina può influire sull’equilibrio lipidico complessivo, aumentando innanzitutto il rilascio di peptide-1, ormone anoressigenico, simile al glucagone e diminuendo l’espressione dei geni coinvolti nel trasporto degli acidi grassi intestinali e nella lipogenesi.
Può, inoltre, agire direttamente sull’adipocita, sul fegato e sulle cellule muscolari, attivando il catabolismo lipidico e favorendo la riduzione dell’adiposità.
Come spesso si sta riscontrando, anche in questo caso la relazione tra leucina e microbiota sta emergendo come fattore chiave. Sembra infatti che il metabolismo lipidico indotto dalla leucina sia strettamente correlato a quello del microbiota intestinale, poiché i batteri possono aiutare l’assorbimento di questo aminoacido nelle cellule epiteliali intestinali e intervenire nel metabolismo della leucina stessa. Non è però ancora chiaro in che modo la leucina interagisca con il microbiota intestinale per regolare il metabolismo lipidico e prevenire l’obesità.
La Malnutrizione e il suo impatto su Sistema Immune e Microbiota
L’utilizzo di farmaci, come ad esempio gli inibitori di pompa protonica (PPI), la cottura non adeguata dei cibi, una non corretta masticazione, frequente soprattutto con la senescenza o correlata a problemi dentari, ma anche in chi mangia frettolosamente, inadatti abbinamenti alimentari che impediscono la corretta digestione dei nutrienti, creano malnutrizione.
La denutrizione, quanto più essa è precoce, secondo recenti studi scientifici, aumenta il rischio di obesità in età avanzata.
Un alterato metabolismo invece porta a infiammazione cronica e disfunzione intestinale, mentre l’energia in eccesso e l’assunzione di macronutrienti è spesso coincidente con carenze di micronutrienti in soggetti in sovrappeso.
Tutto ciò, come ci dice Bourke nella sua review del 2016, può essere sinonimo di una disfunzione a livello immunitario.
Una recente review scientifica ha identificato 245 studi pubblicati tra il 1957 e il 2014 che descrivono alcuni parametri del sistema immunitario nei bambini denutriti (età 0 – 5 anni).
Emerge chiaramente come la malnutrizione comprometta tanto il sistema immunitario innato quanto quello adattativo.
Nel primo caso sono stati notati un’alterazione della barriera epiteliale e compromesse funzioni intestinali, una ridotta attività antibatterica dei granulociti, un ridotto numero di cellule dendritiche circolanti e una risposta alle infezioni esterne molto debole.
Riferito invece all’immunità adattativa sono state evidenziati livelli ridotti di IgA solubili nella saliva e nelle lacrime, atrofia degli organi linfoidi, un ritardo nella risposta dei linfociti B circolanti dovute a un quantitativo inferiore ai livelli normali.
Studi più recenti cercano di definire la malnutrizione andando a valutare ulteriori parametri quali l’arresto della crescita, fino ad esplorare l’ontogenesi immunitaria, l’epigenetica, il microbioma intestinale e il viroma, l’enteropatia e il rilevamento dei nutrienti.
L’immunodeficienza è anche una caratteristica della sovralimentazione, studi immunologici su bambini in sovrappeso e obesi confermano un’ immunopatogenesi data da una più generale malnutrizione.
Un trial clinico ha analizzato lo sviluppo immunitario infantile durante i primi 1000 giorni di vita.
Si è osservato come questo sia sensibile allo stato nutrizionale, tale da compromettere la crescita degli organi immunitari e l’atrofia del timo. Andando a valutare infatti la dimensione del timo, si è osservata un rallentamento della crescita nel gruppo di ratti esposto alla PEM rispetto al gruppo correttamente nutrito. Inoltre è emersa una maggior risposta proinfiammatoria e un aumento dell’attività apoptotica dei timociti, i precursori dei linfociti T presenti nel timo. Queste osservazioni rafforzano la relazione che esiste tra nutrizione, crescita e sviluppo immunitario, di cui la dimensione timica evidentemente è un indicatore.
È sempre più evidente inoltre come la malnutrizione può influenzare lo sviluppo immunitario anche prima del concepimento. Analizzando la malnutrizione materna si è vista essere in grado di conferire modificazioni epigenetiche alla sua prole.
Lo studio, che è stato condotto in Gambia, nel quale le donne che hanno concepito durante periodi di scarsa disponibilità di cibo avevano concentrazioni plasmatiche inferiori di substrati di metilazione a livello di DNA rispetto alle donne che hanno concepito durante i periodi con superiore disponibilità di cibo e i loro bambini presentavano percentuali distinte di metilazione di epialleli metastabili noti a 2-8 mesi di età. Uno studio randomizzato, in doppio cieco, con un primo gruppo di controllo con placebo e un secondo trattato con integrazione mirata di micronutrienti ha permesso di osservare differenze nel DNA infantile. Questo suggerisce che l’integrazione di micronutrienti materni ha avuto un impatto duraturo sull’epigenoma immunitario del bambino.
Evidenze scientifiche affermano come anche il microbiota intestinale giochi un fattore importante nello schema complessivo della malnutrizione.
Il microbiota svolge un ruolo diretto nella digestione, metabolizzando i nutrienti che l’intestino umano non assimila. Senza l’attività dei batteri, lo sviluppo immunitario della mucosa e la digestione sarebbero compromessi, così come il sistema immunitario stesso è in grado di influenzare la composizione del microbiota.
A differenza delle cellule epiteliali intestinali, che sono separate il lume intestinale da uno strato di muco e meccanismi di difesa innata, il microbiota è in stretto contatto con il cibo ingerito, facendo nascere il concetto che il microbiota è un sensore di cambiamento nella dieta.
Questa ipotesi è stata confermata attraverso modifiche sistematiche di proteine alimentari, grassi, polisaccaridi e semplici zuccheri nei topi da laboratorio, popolati con 10 specie batteriche intestinali umane definite, in cui ogni sostanza nutritiva governava composizioni microbiche distinte. Sono stati i cambiamenti proteici a rappresentare le maggiori variazioni.
Il sequenziamento dell’RNA ribosomiale di batteri in campioni fecali umani provenienti da paesi in via di sviluppo ha messo in evidenza il contributo specifico del microbiota alla malnutrizione nei bambini. Questi modelli possono essere generati tramite trapianto fecale da bambini con sindrome da malnutrizione in topi da laboratorio. Questo ha permesso di studiare la plasticità microbica legata all’età, fattori ambientali come la dieta, agenti patogeni e l’esposizione al lavaggio.
Rispetto ai bambini adeguatamente nutriti di pari età, i bambini con sindrome da malnutrizione hanno difetti nella diversità e nella composizione di batteri commensali, definendo quella che chiamiamo “immaturità del microbiota”. Anche se gli interventi di alimentazione terapeutica favoriscono i cambiamenti nel microbiota intestinale dei bambini con sindrome da malassorbimento, il viroma non è interessato e il microbiota batterico ritorna alla sua composizione pre-intervento al termine di questo. Anche nei topi da laboratorio in cui è stato trapiantato il microbiota di bambini denutriti sono stati osservati risultati simili. Durante il periodo in cui gli animali venivano nutriti con cibo ricco di nutrienti, questo rispondeva con un adattamento positivo, per poi regredire una volta che i topi sono tornati a una dieta iniziale povera di nutrienti, riflettendo anche l’impatto diretto di alterazioni batteriche sulla digestione.
L’ambiente in cui l’essere umano risiede ha anch’esso un impatto modificando la composizione del microbiota.
Si è osservato come in aree rurali una popolazione sudafricana è stata nutrita con una dieta “occidentalizzata” ricca di grassi e povera di fibre, condotta in ambiente domestico. Queste osservazioni dimostrano che la composizione dei microbiota e la qualità della digestione dei nutrienti vengono rapidamente riconfigurate da interventi dietetici, ma quando si manterrà la stessa alimentazione tornando ad abitare un’area rurale, questi cambiamenti non saranno definitivi, evidenziando il ruolo dominante che ha l’ambiente.
È quindi evidente che la mortalità infettiva è elevata nella denutrizione e nell’obesità e che l’immunodeficienza è un segno distintivo della malnutrizione.
La disfunzione immunitaria non è quindi solo una conseguenza di una dieta inadeguata, ma contribuisce anche direttamente alla mortalità e alla morbilità associate alla malnutrizione. Dati emergenti da modelli animali e coorti umane indicano che la disfunzione immunitaria è alla base dell’eziologia della malnutrizione all’inizio del corso della vita, attraverso modificazioni epigenetiche dei geni immunitari infantili; l’influenza dell’infiammazione cronica sugli ormoni della crescita, la segnalazione di HPA, l’adiposità e il metabolismo; struttura e funzione dell’intestino alterata e ridotta protezione immunomediata dalle infezioni.
Ottenere consapevolezza sul tema è essenziale per sostenere nuovi approcci terapeutici per migliorare l’alimentazione, la salute e il benessere.
La Sarcopenia
Sicuramente, in virtù delle ultime evidenze scientifiche, uno dei maggiori campi di utilizzo di un pool amminoacidico, per quanto possibile, tarato sulle esigenze umane, è la gestione e il supporto al paziente sarcopenico.
Alla luce dell’invecchiamento della popolazione in rapida espansione, la sarcopenia e i disturbi correlati stanno emergendo come un grave problema di salute pubblica del XXI sec.
Un’altra conseguenza della sarcopenia dell’invecchiamento è un cambiamento deleterio nella composizione corporea che si traduce in molte alterazioni metaboliche, che portano alla sindrome metabolica e ad un aumentato rischio di malattie cardiovascolari.
E’ una patologia che si correla a una perdita numerica delle fibre muscolari con atrofia delle fibre rimanenti. Interessa quasi esclusivamente le fibre di tipo II che sviluppano forza.
La sarcopenia ha un esordio attorno alla quarta decade di vita, con perdita di massa muscolare del 3-5% entro i 50 anni, successivamente si correla una perdita del 1-2% ogni anno. In molti soggetti il patrimonio muscolare viene dimezzato entro i 75 anni di età.
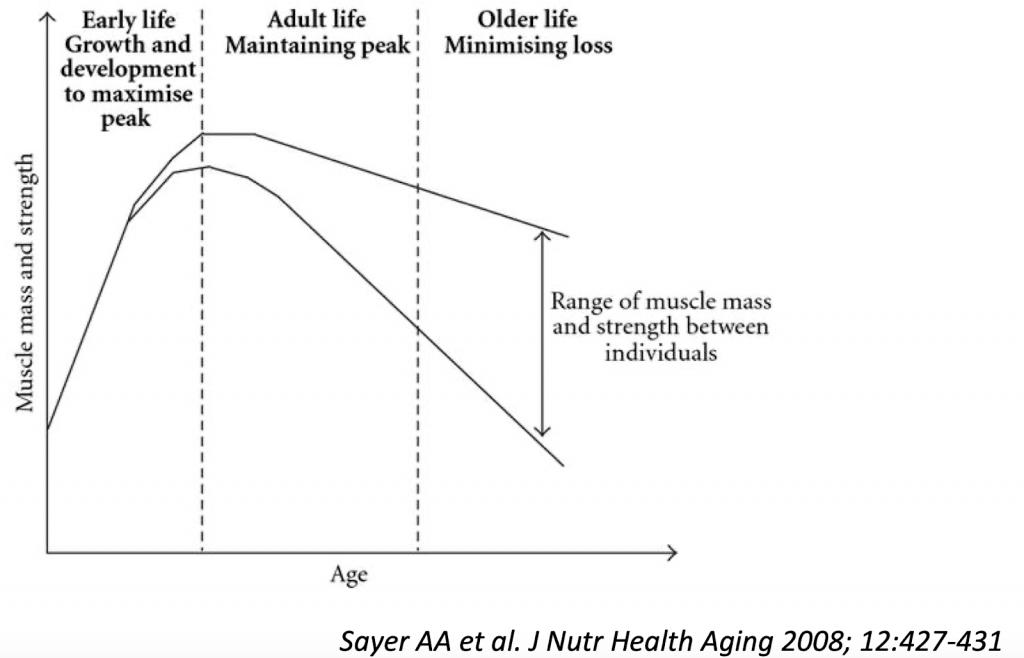
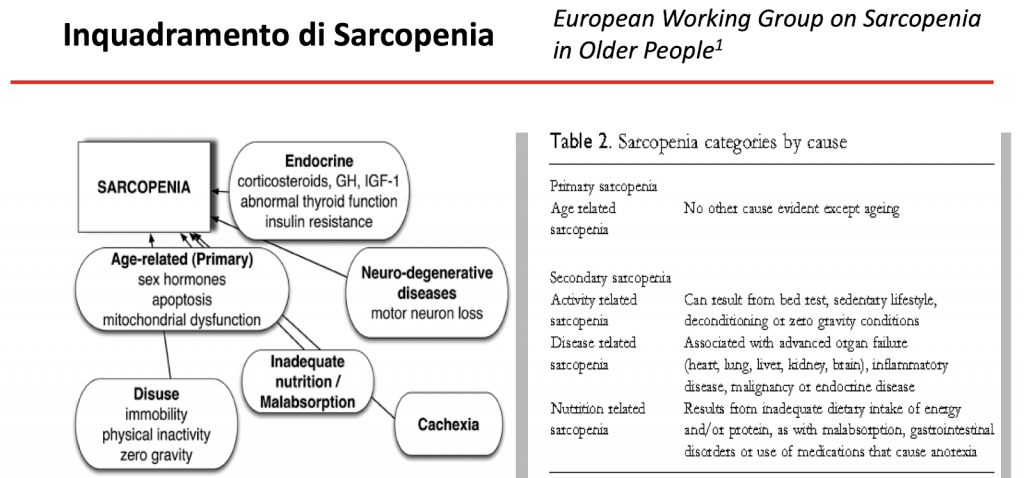
Nel soggetto anziano risulta estremamente utile controllare la massa muscolare poiché le conseguenze della sarcopenia risultano gravi: aumenta infatti il rischio di cadute e di fratture.
Nei soggetti affetti da sarcopenia il rischio di caduta è quattro volte più alto rispetto a quelli con muscolatura adeguata.
L’utilizzo di una dietoterapia personalizzata è essenziale per evitare carenze e successive deplezioni muscolari. La gestione dell’introito proteico risulta quindi di primaria importanza.
Nuove evidenze hanno mostrato come gli individui più anziani necessitino di un intake proteico maggiore rispetto ai giovani, con lo scopo di supportare la buona salute, promuovere il recupero a
seguito di patologie e mantenere la funzionalità corporea. Inoltre, hanno bisogno di più proteine per spegnere l’infiammazione e le condizioni cataboliche associate a patologie croniche e/o acute che spesso si correlano con l’invecchiamento.
Supplementi a base di Proteine o di amminoacidi essenziali (AAE) possono ridurre la perdita muscolare da inattività, ma andrebbero inseriti in un approccio integrato che include:
- Nutrizione
- Esercizio
- Intervento farmacologico (se indicato)
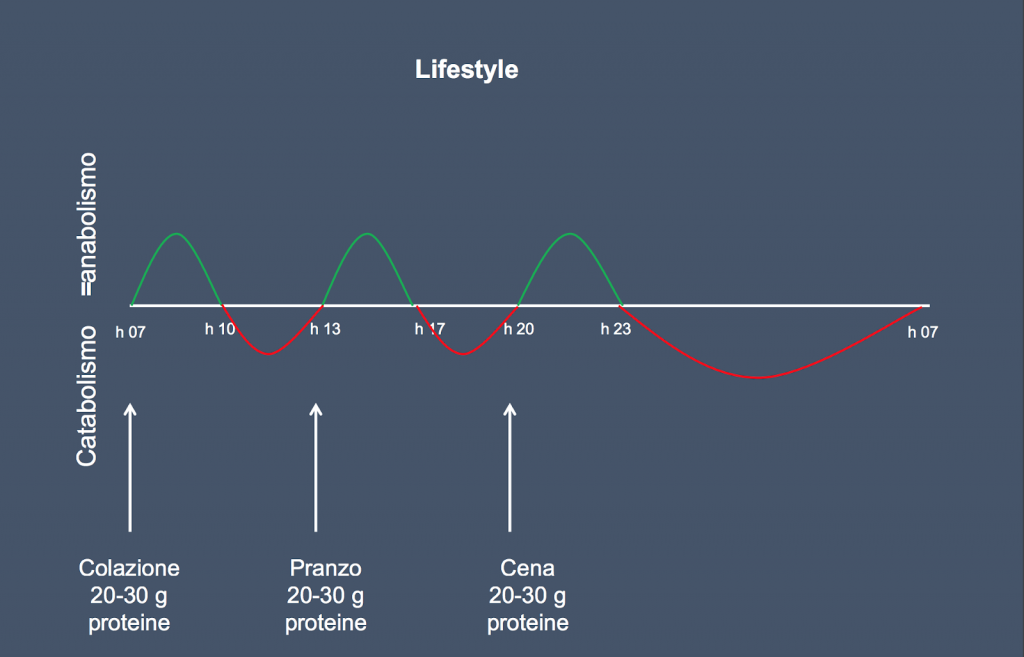
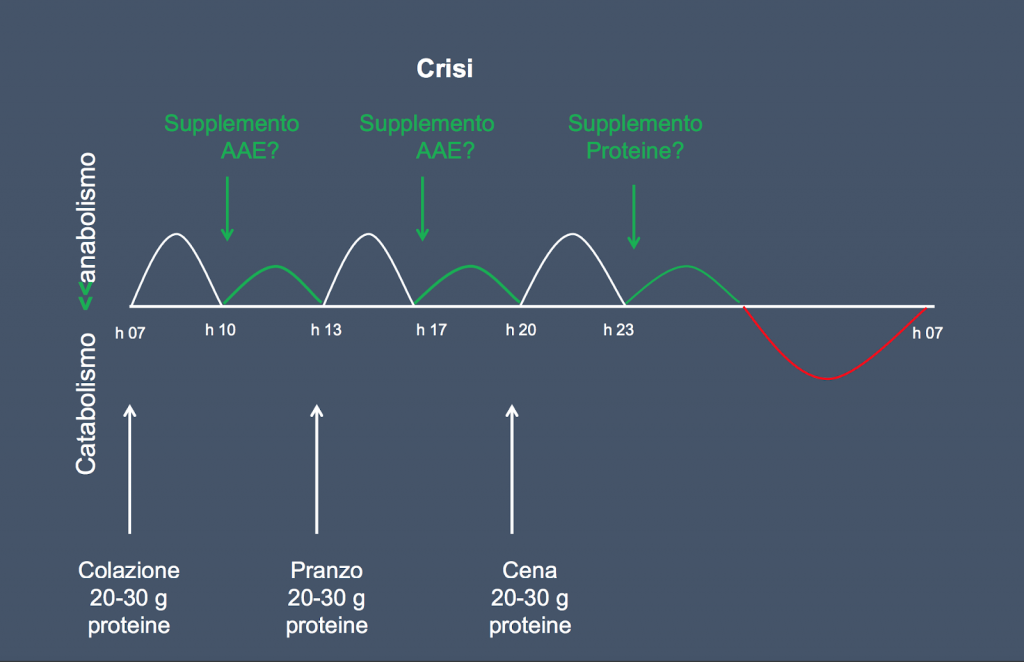
Due sono i livelli di intervento: il primo riconducibile ad un miglioramento dello stile di vita, il secondo mirato alla gestione di una fase di “crisi”.
Con il primo ci limitiamo a consigliare un consumo di 25 – 30 g di proteine ad alto valore biologico ad ogni pasto ed un esercizio fisico abituale in prossimità temporale con l’assunzione di proteine.
Con il secondo livello dobbiamo reagire in modo tempestivo ed aggressivo per contrastare la perdita di massa e funzione muscolare dovuta a crisi catabolica e come strategia di base ciò dovrebbe includere un supporto nutrizionale con AAE o proteine ed andrebbe associata terapia di esercizio fisico.
Ciò porta inevitabilmente a ridefinire il fabbisogno proteico nell’anziano e nelle patologie catabolizzanti, con l’unico scopo di fornire i substrati necessari per contrastare la perdita di massa magra e favorire l’anabolismo in associazione ad attività fisica e per contrastare il declino metabolico (deficit mitocondriale) dell’anziano o del malato cronico.
Ciò che fa partire la catena di montaggio è l’aumentata disponibilità ceIlulare di AA essenziali, indipendentemente dalla concentrazione plasmatica di AAE di partenza.
Per sostenere le sintesi proteiche nel tempo devono essere presenti tutti gli AA essenziali, non bastano i soli ramificati, la sola leucina o l’idrossimetilbutirrato, meglio conosciuto come HMB.
Gli AA essenziali devono rispettare concentrazioni specifiche, ossia specifici rapporti stechiometrici, tarati sulle esigenze umane.
Deve essere somministrato un quantitativo sufficiente a generare un delta di concentrazione plasmatico, ossia almeno 4g di AAE.
L’ingestione orale di aminoacidi essenziali (EAA) stimola la sintesi proteica muscolare nei giovani e negli anziani e non sembra influire sulla proteolisi muscolare degli arti, sebbene gli EAA, soprattutto se somministrati per via endovenosa, riducano la proteolisi muscolare in toto. Risultati simili per la sintesi proteica muscolare sono stati raggiunti durante l’infusione di una miscela di aminoacidi e gli effetti non erano esclusivi per i muscoli, inclusa anche una stimolazione della sintesi proteica e l’inibizione della proteolisi anche a livello viscerale.
L’assunzione di AA può essere raggiunta in modo più efficace dal punto di vista economico, come già anticipato, aumentando l’assunzione di proteine, ma tali studi hanno dimostrato un aumento del bilancio azotato senza, non sempre, un adeguato miglioramento della funzione muscolare.
Un’altra preoccupazione emersa nello stesso studio è che le diete ricche di proteine possono peggiorare il tasso di clearance renale negli anziani. Pertanto risulta di grande vantaggio l’utilizzo di EAA in grado di aumentare la massa muscolare e funzionare senza effetti negativi nelle persone anziane.
Sono stati riportati risultati positivi per l’integrazione di EAA cronica negli anziani anche per quanto riguarda l’aumento della massa magra, la forza delle gambe, la misura dell’handgrip e nelle capacità deambulatorie.
Rimane incerto se anche le proteine, come i fattori della coagulazione sintetizzati nel fegato, possano essere aumentate dall’effetto anabolico generale di EAA.
Inoltre, sono necessarie ulteriori valutazioni delle prestazioni, come la capacità aerobica massima poiché gli EAA possono potenzialmente aumentare il volume dei mitocondri dei muscoli scheletrici, oltre alla possibilità di sviluppare un aumento nel numero di proteine contrattili loro. Come affermato in precedenza, sebbene la somministrazione esogena di AA porti ad un aumento della sintesi proteica nei muscoli, questa promuove anche la sintesi proteica e una ridotta proteolisi all’interno del letto splancnico. Pertanto, è particolarmente indispensabile confermare che gli aumenti di massa magra si verificano effettivamente all’interno dei muscoli scheletrici, perché gli AA possono essere anabolici nei tessuti non muscolari, il che potrebbe non essere rilevante per il problema della sarcopenia.
In sintesi, i risultati di Dillon et al. ad esempio, forniscono risultati preliminari promettenti che indicano che l’EAA può fornire protezione contro la sarcopenia negli adulti sani che invecchiano.
Bibliografia
Leucine supplementation: a novel strategy for modulating lipid metabolism and energy homeostasis. Nutrients 2020, 12(5), 1299.
Metabolism and acetylation contribute to leucine-mediated inhibition of cardiac glucose uptake. J Physiol Heart Circ Physiol. 2017 Aug 1;313(2):H432-H445.
Effect of protein supplementation during diet-induced weight loss on muscle mass and strength: a randomized controlled study. Obesity (Silver Spring) 2018 May;26(5):854-861.
Leucine supplementation attenuates macrophage foam-cell formation: studies in humans, mice, and cultured macrophages. Biofactors 2018 May;44(3):245-262.
Leucine in obesity: therapeutic prospects. Trends in pharmacological sciences; Volume 37, Issue 8August 2016; Pages 714-727.
Leucine as a treatment for muscle wasting: a critical review. Clinical NutritionVolume 33, Issue 6, December 2014 Pages 937-945.
Douglas Paddon-Jones and Blake B. Rasmussen, Dietary protein recommendations and prevention of sarcopenia. Protein, amino acid metabolism and therapy. Curr Opin Clin Nutr Metab Care. 2009 January; 12(1): 86–90.
Dillon EL, Sheffield-Moore M, Paddon-Jones D, Gilkison C, Sanford AP, Casperson SL, Jiang J, Chinkes DL, Urban RJ 2009 Amino acid supplemen- tation increases lean body mass, basal muscle protein synthesis, and IGF-1 expression in older women. J Clin Endocrinol Metab 94:1630 –1637
Paddon-Jones D, Sheffield-Moore M, Zhang XJ, Volpi E, Wolf SE, Aarsland A, Ferrando AA, Wolfe RR 2004 Amino acid ingestion improves muscle pro- tein synthesis in the young and elderly. Am J Physiol Endocrinol Metab 286: E321–E328
Short KR, Bigelow ML, Kahl J, Singh R, Coenen-Schimke J, Raghavakaimal S, Nair KS 2005 Decline in skeletal muscle mitochondrial function with aging in humans. Proc Natl Acad Sci USA 102:5618 –5623
Børsheim E, Bui QU, Tissier S, Kobayashi H, Ferrando AA, Wolfe RR 2008 Effect of amino acid supplementation on muscle mass, strength and physical function in elderly. Clin Nutr 27:189 –195
Scognamiglio R, Piccolotto R, Negut C, Tiengo A, Avogaro A 2005 Oral amino acids in elderly subjects: effect on myocardial function and walking capacity. Gerontology 51:302–308
Iscriviti alla newsletter
In Caso Di - SNC
di Garruba Francesco e Eugenio Genesi
P. Iva: 04097901203
Via Orsoni 52, Bologna
© InCasoDi. All rights reserved. Designed by Mario d'Anelli.


